
크리스탈지노믹스
- 시총 7,200억
- 슈퍼박테리아 박멸 항생제 / 분자 표적 항암제 신약 개발
- 차세대 관절염 진통소염제 ' 아셀릭스' 시판 중 - 브라질 수출 임박하여 캐시카우 예정
- 연결대상 종속기업으로 완제의약품 기업인 크리스탈생명과학 등 5개사를 보유
* 대주주 현황 : 조중명 외 4인 9.07% / 금호에이치티 5.2%
- 주요 파이프라인
1) 분자 표적 항암제 CG-745 (췌장암 등)
2) 분자 표적 항암제 CG-806 (혈액암)
3) 슈퍼 박테리아 항생제 CG-549
4) 코로나19 치료제
5) 바이오벤처 최초 허가 신약, 차세대 관절염 진통소염제 아셀릭스 (캐시카우 예정)

- 기술 이전 현황
- 16' 미국 Aptose사에 CG-806 (혈액암 분자표적항암제) 기술 수출 (중국/한국 제외 전세계 판권) : 약 3,500억원
- 18' 미국 Aptose사에 CG-806 (혈액암 분자표적항암제) 기술 수출 (중국 독점 판권) : 약 1,400억원
* 그 이후 새로운 기술 이전은 없음. 추가 기술 이전 시 큰 폭으로 성장 기대.
I. 주요 파이프라인
1. CG-745 (아이발티노스타트, 췌장암 등 표적항암제)
- 췌장암 임상 2상 완료
- 골수형성이상증후군 임상 2상 진행 중
- 급성골수성백혈병 임상 예정
- 간암 대상 타사의 PD-1항체신약과 병용임상 미국 2상 진행 예정 (2021년)
- 해외에서 코로나19 치료제로도 임상 중
1) 기전
- HDAC(히스톤단백질의 탈아세틸화)를 저해하는 분자표적항암제
2) 최근 연구 성과
① 20' 3월 췌장암 표준치료제인 젬시타빈(젬자)/엘로티닙(타쎄바)과의 국내 병용 임상 2상 완료
- 6주기 이상의 치료를 완료한 환자군에서 생존기간 중간값이 5.5개월 → 11.7개월로 생명 연장 개선 효과를 입증
- 6주기 투약을 완료한 65세 이상 고연령군에서 6주기 미만 투약한 대상자들에 비해 월등히 우수한 효과를 보임에 따라 연령과 상관없이 사용 가능함을 확인함
- 안전성 측면에서도 이상 반응 발생율은 현저히 개선되었으며, 새롭게 발생한 심각한 이상반응은 없었음
② 2020.11.8 췌장암치료제 신속심사제도 지정 : 조건부 품목허가 심사기간이 단축 (120일 → 90일)
- 식약처 승인을 거쳐 2021년 4월 전후 국내에서 품목 승인 가능
- 2021년 상반기까지 미국임상 2상을 진행할 계획
③ 2020.01.11 급성골수백혈병 미국 FDA 희귀의약품 지정
★ 2021 JP모건 헬스케어 컨퍼런스 참가
"크리스탈지노믹스는 내년 JP모건 헬스케어콘퍼런스에서 투자자와 글로벌 바이오 제약사들을 대상으로 항암·항섬유증 치료 신약 후보 아이발티노스타트 데이터를 중심으로 발표할 계획이라고 전했다."
2. CG-806 (혈액암 표적항암제)
- 세계 최초의 질환표적인 FLT3/BTK 다중 저해 신약후보
- 미국 앱토즈 사에 기술이전 (한국 제외 전 세계 판권)
- FDA 희귀의약품 지정
- 현재 임상 1상 중
1) 기전
- FLT3-BTK 다중 저해 치료제
- 급성 골수성백혈병 및 만성 림프구성 백혈병을 타깃으로 개발 중
2) 최근 연구 성과
* 2020.12.08 미국 혈액학회(ASH)에서 임상 1상 중간 결과 발표
- 만성 림프구성 백혈병 : 다수의 핵심 종양 타깃(BTK 포함)과 경로를 강하게 저해하며, 여러 종의 암에서 종양 크기 감소를 확인 / 안정성 확인
- 급성 골수성 백혈병 : 환자 1명에게서는 백혈병 모세포 수치 93%에서 10%로 감소 확인
* 2021.03.24 미국 앱토즈 바이오사이언스 연간보고서, 임상 1상에서 완전 관해 확인 기사
- CG-806 450mg을 하루 2회 투약한 환자에게서 완전 관해 확인, 여러 차례 투약한 환자에서도 부작용 없이 안전했음.
3) 모멘텀
* 21년 6월 유럽혈액학회(EHA)에서 임상 1상 데이터 발표 예정
3. CG-549 (수퍼박테리아 항생제)
- 유럽 임상 1상 종료
1) 기전
- 치명적 슈퍼박테리아로 알려진 메치실린 내성 황색포도상구균(MRSA)과 벤코마이신 내성 황색포도상구균(VRSA)을 적응증으로 개발 중
2) 최근 연구 성과
① 2020.07 유럽 1상 종료
- 이미 캡슐 경구제로서 유럽/미국에서 임상1/2a상으로 안전성/유효성 입증함 (3일내 91%, 2주내 100% 완치)
- 그러나 체내 흡수율 개선을 위해 정제형 경구제로 변경하여 임상 1상 진행하였으며, 내약성/안전성을 확인함
- 임상 2상 미국에서 진행 예정
4. 코로나19 치료제 (국내/해외 총 2종)
1) 국내 : 카모스타트(세린계 단백질 가수분해 효소억제제)를 활용한 코로나19 치료제 (CG-CAM20) 임상 2상 승인
- 아직 임상 2상 개시 전
2) 해외 : 아이발티노스타트(CG-745)를 코로나19 치료제로 미국 임상 2상 준비 중
- 세계 3대 CRO중 하나인 파렉셀과 임상 진행 계약 체결
- 연내 미국 FDA 승인 기대
5. 차세대 관절염 진통소염제 ' 아셀릭스'
- 현재 국내 시판 중
- 바이오벤처 기업으로는 1호 신약허가
1) 기전
- 골관절염 진통소염제로, 체내에서 염증, 통증 등을 유발하는 프로스타글라딘의 형성에 작용하는 2가지 동종 효소인 시클로옥시게나제(COX-1, COX-2) 중 COX-2만을 선택적으로 저해하는 기전의 약물
- 기존 비스테로이드성 항염제의 위경련, 위장장애 등 소화관계 부작용을 극복할 수 있도록 고안
2) 실적 현황
* 브라질
- 2018년 브라질 제약사인 압센 파마슈티카와 약 1950억원 규모의 아셀렉스 2mg캡슐 수출 계약 체결
- 2020.12.17 브라질 식약처 허가 신청 완료 : 브라질 당국의 시판 허가가 이뤄지면 매출에 따른 마일스톤 1억6500만 달러(약 1800억원) 등의 성공보수 수령 예정 (계약 기간은 시판 허가 후 10년)
* 러시아
- 2020.12.22. 러시아 시판 허가를 위한 임상 3상 성공적 종료
화이자의 '쎄레브렉스'를 비교군으로 임상 실험 결과, 쎄레브렉스보다 아셀렉스의 투여 용량이 100분의 1에 불과했는데도 동등한 효과가 나타났음.
- 2020.01.04. 러시아 연방 보건부에 신약 판매를 위한 허가 신청(NDA)을 완료
크리스탈지노믹스 관계자는 “러시아에서 아셀렉스가 속한 COX-2저해제 시장이 가장 높은 연간 30%가 넘는 성장률을 보이고 있어 캐쉬카우 역할을 본격적으로 할 것“이라고 말했다.
6. 기타
1) 화일 약품 지분 절반 엑싯 (2020.11.19)
- 화일약품은 최대주주였으나, 보유주식 300만주(총 324억원)를 처분하여 현금 흐름성 확보
3) 자회사 마카온 280억원 투자 유치 (2020.11.11)
- 마카온은 크리스탈지노믹스가 지난 7월 섬유증 치료제 개발을 위해 설립한 자회사
- 크리스탈지노믹스는 신약 후보물질 '아이발티노스타트'를 섬유증 치료제로 개발할 권리를 마카온에 이전(약 1천억원)
- 최근 사모펀드 뉴레이크얼라이언스는 240억원은 보통주, 40억원을 전환사채(CB)로 투자
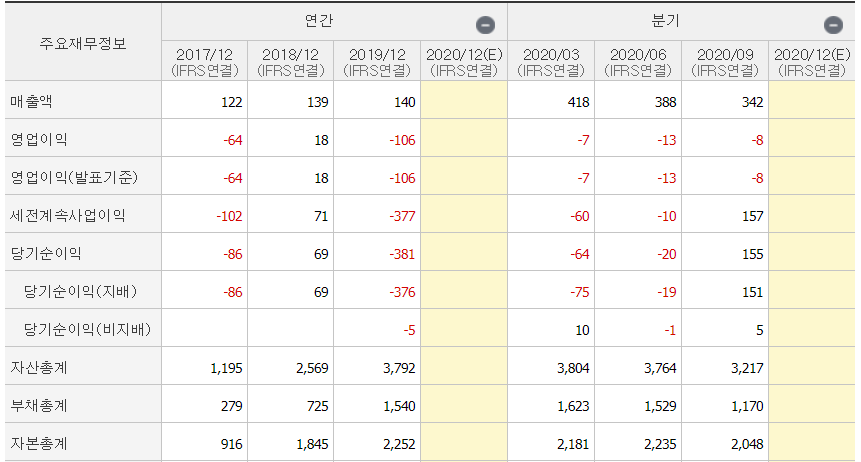
II. 재무재표
- 올해 매출 큰폭으로 성장 (3분기까지 매출만 합쳐도 전년대비 1000%)
- 아직 영업이익은 적자이지만, 부채율은 높지 않음 (약 60%)
'국내) 섹터 및 종목, 주요 뉴스 분석 > 제약, 바이오, 헬스케어' 카테고리의 다른 글
| 2021 JP모건 헬스케어 관련주 총 정리 (updated 20.01.11) (2) | 2020.12.21 |
|---|---|
| 메드팩토 임상 총 정리 (21.12.16 updated) (5) | 2020.12.15 |
| 지놈앤컴퍼니 총 정리 - 2021 AACR 관련주 (21.03.09 updated) (0) | 2020.12.07 |
| 나이벡 주요 파이프라인 및 임상 일정 총 정리 - 2022 JP 모건 바이오 컨퍼런스 관련주 (21.12.09 updated) (1) | 2020.11.30 |
| 레고켐바이오 주요 파이프라인 및 임상일정 총 정리 (updated 20.12.03) (0) | 2020.11.27 |




댓글